水と油は混じり合いません。
みなさんも洗い物をする時に、水面に油が浮かんでいる状況がありますよね。
そして油が浮いているところへ、スポンジを使うかどうかを一度悩みます。
結果、なるべく手洗いで目立った油をすすぎ落としてから、洗剤を直接フライパンの上に引いて水で洗い流し、最終的にスポンジで洗うという戦略を取ります。
本記事では、初めに水と油が混じり合わない理由を紹介し、具体例として油成分でコーティングされたウルシやハゼノキ、ナンキンハゼの種を植える際の注意点についてご紹介していきます。
最後までお付き合い頂けると幸いです。
なぜ水と油は混じり合わないのか!?

水面に油が浮く理由として「密度」と「極性」が関係しています。
まず、説明が簡単な「密度」から解説していきます。
例として「浮き」を例に挙げます。
浮きは、中に空気を内包しています。
「空気」の密度は約0.0012(g/c㎥)であり「水」の密度は1.0(g/c㎥)です。
簡単ですが、以上が「浮き」が水面に浮き上がる理由になります。
この密度の差が大きければ大きいほど、一度水に沈めた場合に、浮き上がってくる速度が大きくなります。
そのため一度「浮き」を沈めると、勢い良く浮上するのはご存知の通りです。
また「油」の密度は約0.9(g/c㎥)であり、水より軽いため水面に油が浮きます。
「極性」により水と油は混じり合わない!?

「密度」の差によって、水面に油が浮くことは分かりました。
しかし「極性」にも違いがないと、水と油は分離しません。
例えば、お酒のアルコールの原料である「エタノール」の密度は、約0.8(g/c㎥)ですが、分離することはなく、水とエタノールは混ざります。
これは水とエタノールの「極性」が同じである結果です。
「極性分子」と「無極性分子」とは!?
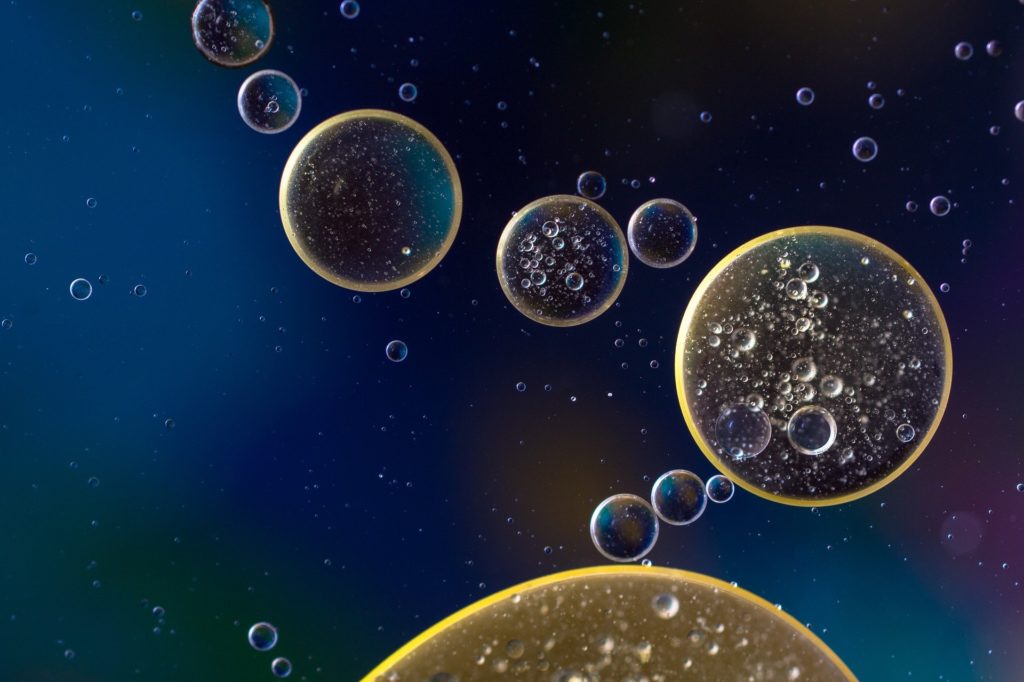
ここから、詳しく解説していきます。
「極性」とは「電子の偏り」になります。
例えば、プラス(+)とマイナス(−)が引き合うことは、皆さんご存知であると思います。
電子も磁石と同じように、(+/−)であると引き合い、(+/+)や(−/−)であると反発します。
「水」と「油」も、一つ一つの分子の集合体であり、一つ一つの分子は電子を持っています。
しかし、まずここで水分子は「極性分子」であり、油分子は「無極性分子」であることを覚えてください。
先程「極性」とは「電子の偏り」であると述べました。
水分子は「極性分子」、つまり「電子の偏り」があるという事になります。
対して、油の分子は「無極性分子」であり「電子の偏り」がないという事になります。
これは一体どういう事なのでしょうか。
順を追って解説していきます。
分子の電子の偏りとは!?

「水」の分子は「H2O」という分子式で表現されています。
これは「H(水素原子)が2つと、O(酸素原子)が1つ」という構成になっています。
水分子は、この3つの原子の結合によって形成されています。
※この結合を「共有結合」と言います。
また、この結合とは別に、原子にはそれぞれ電子を引っ張る力があります。
この電子を引っ張る力の大小を「電気陰性度」と呼びます。
「電気陰性度」の説明は今回は省略しますが、電子を引っ張る力の強さの序列は以下の順序になります。
H(水素)<C(炭素)<Cl(塩素)=N(窒素)<O(酸素)<F(フッ素)
このように、H(水素原子)が最も電子を引っ張る力が弱く、反対にF(フッ素原子)が最も電子を引っ張る力が強いことになります。
以上までを理解したところで、「水」の分子「H2O」の構造を見てみましょう。
「水」の分子構造は「H-O-H」で表され、O(酸素原子)が中央に陣取っています。
この結果、上の「電気陰性度」序列を参考に、電子を引っ張る力が強いO(酸素原子)が、最も電子を引っ張る力が弱いH(水素原子)の電子をほとんど奪っているという構図になります。
その結果「H-O-H」の分子構造は「H(+)-O(−)-H(+)」という「電子の偏り」が生まれます。
この理由が「水」が「極性分子」と言われる所以になります。
しかし、この「極性分子」の状態は、非常に危険な状況になります。
なぜなら、H(水素原子)の立場からすると、電子がを奪われ「電子が欲しい(足りていない)」という状況になっているためです。
また、先述の通り「水」は一つ一つの分子の集合体であります。
その結果、プラス(+)のH(水素原子)は、隣分子のマイナス(−)であるO(酸素原子)の電子にくっつきに行きます。
これがいわゆる「水素結合」と呼ばれるものです。
※ポイント1:「H(+)-O(−)-H(+)」の一つの水分子は「共有結合」によって「H2O(水分子)」を形成している。
※ポイント2:「水素結合」は、例えば「水分子A」のH(水素原子)プラス(+)と、隣り合う「水分子B」のO(酸素原子)マイナス(−)が引き合っている状態です。
このように「水」はたくさんの水分子が、磁石のようにプラス(+)とマイナス(−)で強力に引き合っている状態と言えます。
なぜ油は「無極性分子」であるのか!?

対して油は、例えば分子式で「CnH2n+2」と表現されます。
このように油の場合は、H(水素原子)とC(炭素原子)の集合体であると言えます。
先ほどの「電気陰性度」の序列を振り返ってみましょう。
H(水素)<C(炭素)<Cl(塩素)=N(窒素)<O(酸素)<F(フッ素)
このように、H(水素原子)とC(炭素原子)の電子を引っ張る力はほとんど変わらず、わずかにC(炭素原子)が強いという状況になります。
このように、ほとんど「電子の偏り」がない分子のことを「無極性分子」と言います。
「無極性分子」は、プラス(+)とマイナス(−)も無い状態なので、油の分子が漂っている状況をイメージして頂けると分かりやすいと思います。
少し詳しく解説しますと、油が「ドロドロっと」まとまっている(固まっている)のは「ファンデルワールス力」によるものであります。
「ファンデルワールス力」についての説明は今回省略しますが、簡単に言いますと、瞬間的にプラス(+)とマイナス(−)に「電子の偏り」が生まれ、隣の分子同士で瞬間的にプラス(+)とマイナス(−)で引っ張り合う状況を指します。
H(水素原子)とC(炭素原子)の中には電子が存在しています。
その電子は、約1000 km/秒のとてつもない速さで、原子内を無秩序に動き回っています。
また、原子は球体であります。
例えば、約1000 km/秒で無秩序に動く電子が、ある瞬間右側に集まってしまった場合を想定してます。
すると反対側(左側)は、電子が足りていない状況、つまり先程の水分子で言うプラス(+)の状況となり、電子が足りていない「電子が欲しい」という状況になります。
反対に右側は、電子が集まっているので、マイナス(−)の状況になります。
この瞬間的な「電子の偏り」で、隣の油分子同士が引き合う力のことを「ファンデルワールス力」と呼びます。
さらに、水分子の「水素結合」と油分子の「ファンデルワールス力」の引き合う力の差は、以下になります。
ファンデルワールス力<<<<<水素結合
これが水と油が混じり合わない理由になります。
油分子の「ファンデルワールス力」に比べ、非常に強い水分子同士の「水素結合」により、水分子が強力な力で集結し、油分子が弾かれるといった状況が生まれます。
そして「密度」がより軽い油が水面に浮く結果になります。
また、先述の「エタノール」は水と同じく「極性分子」であり、プラス(+)とマイナス(−)で水分子と引き合っているため(水素結合)、溶け合っています。
※「エタノール」の分子式は「C2H5OH」であり、この「OH」の部分が水と同じく「O(−)H(+)」の「電子の偏り」を生んでいる。
最後に -タネを植える際の注意点とは!?ウルシ・ハゼノキ・ナンキンハゼ編-

最後まで読んで頂き、ありがとうございました。
「タネを植える際の注意点とは!?ウルシ・ハゼノキ・ナンキンハゼ編」は次回に解説いたします。
最後までお付き合い頂き、ありがとうございました。
以上が「なぜ水と油は混じり合わないのか!?」になります。
「Woodyニュース」はTwitterやFacebookでも、自然や森林に関する様々なニュースを配信しています。ご興味がある方はフォローして頂けると幸いです。







